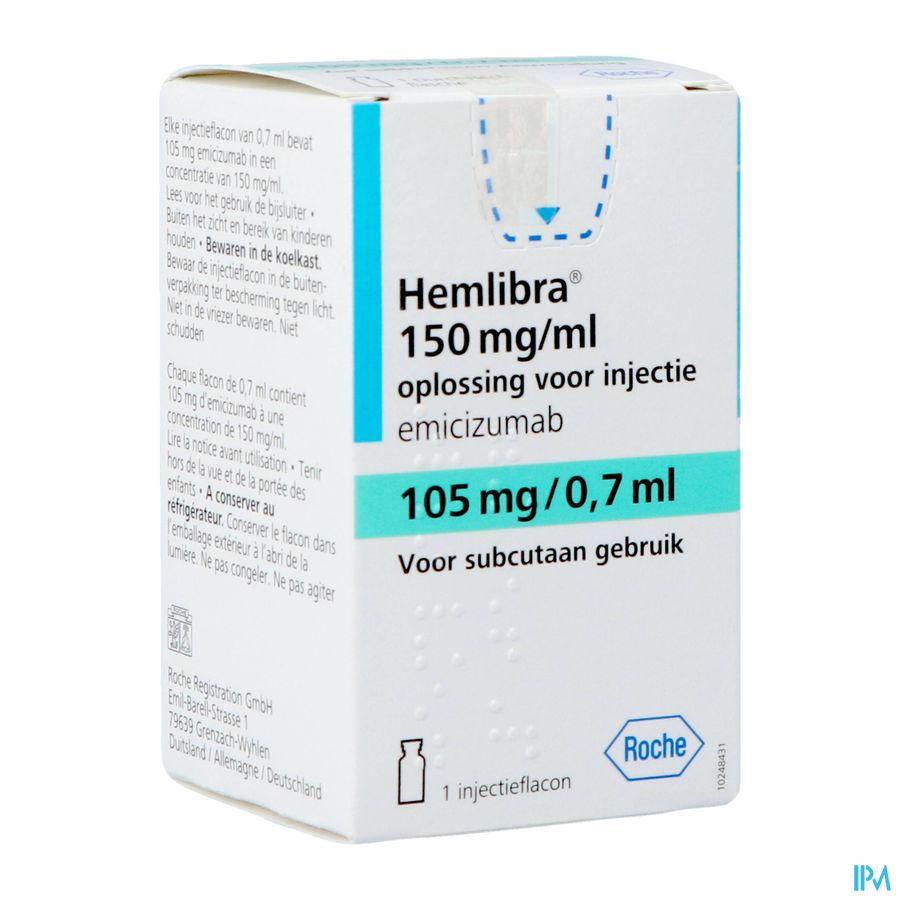
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Het algehele veiligheidsprofiel van Hemlibra is gebaseerd op gegevens uit klinische onderzoeken en toezicht na het op de markt brengen. De ernstigste bijwerkingen die in klinische onderzoeken met Hemlibra zijn gemeld, waren trombotische microangiopathie (TMA) en trombotische voorvallen, waaronder caverneuze sinustrombose (CST) en oppervlakkige veneuze trombose die gelijktijdig optrad met huidnecrose (zie hieronder en rubriek 4.4).
De meest voorkomende bijwerkingen die werden gemeld bij ≥ 10% van de patiënten die met minstens één dosis Hemlibra werden behandeld, waren: injectieplaatsreacties (19,4%), artralgie (14,2%) en hoofdpijn (14,0%).
Ernstige bijwerkingen als u aPCC gebruikt terwijl u ook Hemlibra krijgt
Stop met het gebruik van Hemlibra en aPCC en neem onmiddellijk contact op met een arts als u of uw verzorger een van de volgende bijwerkingen opmerkt:
● Vernietiging van de rode bloedcellen (trombotische microangiopathie):
- verwardheid, zwakte, zwelling van armen en benen, geel worden van huid en ogen, vage buik- of rugpijn, misselijkheid, overgeven of minder plassen - dit kunnen symptomen zijn van trombotische microangiopathie.
● Bloedstolsels (trombo-embolie):
- zwelling, warmte, pijn of roodheid – dit kunnen symptomen zijn van een bloedstolsel in een ader die vlak onder de huid ligt. - hoofdpijn, gevoelloosheid in uw gezicht, pijn of zwelling van de ogen of problemen met het zicht – dit kunnen symptomen zijn van een bloedstolsel in een ader achter uw oog. - zwart worden van de huid – dit kan een symptoom zijn van ernstige beschadiging van het huidweefsel.
Andere bijwerkingen tijdens het gebruik van Hemlibra
Zeer vaak (komt voor bij meer dan 1 op de 10 gebruikers)
● een reactie op de plek waar de injectie is gegeven (roodheid, jeuk, pijn)
● hoofdpijn
● gewrichtspijn
Vaak (komt voor bij minder dan 1 op de 10 gebruikers)
● koorts
● spierpijn
● diarree
● uitslag op de huid met roze bulten en erge jeuk (netelroos of galbulten)
● huiduitslag
Soms (komt voor bij minder dan 1 op de 100 gebruikers)
● vernietiging van rode bloedcellen (trombotische microangiopathie)
● bloedstolsel in een ader achter uw oog (sinus cavernosus trombose)
● ernstige beschadiging van het huidweefsel (huidnecrose)
● bloedstolsel in een ader vlak onder de huid (oppervlakkige tromboflebitis)
● zwelling van gezicht, tong en/of keel en/of problemen bij het slikken. Of netelroos samen met